Como hacer – QUIMICA ANALITICA – EL COBRE (1 de 2)
por francisco José Vallejo
Cationes del Segundo Grupo: COBRE
Nos ocuparemos hoy de las reacciones por vía seca y vía húmeda del cobre, otro de los integrantes del segundo grupo de cationes.
Reacciones por vía seca
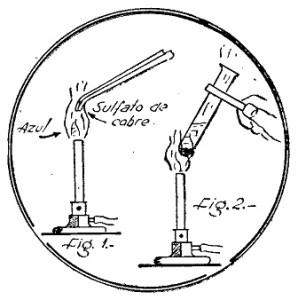
Las sales de cobre colorean la llama de azul o de verde. Para ello hágase el siguiente experimento: con unas pinzas de hierro bien limpias, tómese un cristalito de sulfato de cobre, humedézcaselo con un poco de ácido clorhídrico y lléveselo a la llama de un mechero de Bunsen. Se advertirá que la llama adquiere inmediatamente una coloración verde azulada (fig. 1), característica de las sales de cobre. Repítase el experimento usando otra sal de cobre, sulfuro por ejemplo, y se verá que los resultados son análogos.
Cuando una sal de cobre se calienta con soda sobre el carbón, se obtiene el cobre metálico en forma esponjosa. Mézclese en un mortero un poco de sulfuro de cobre con carbonato de sodio anhidro. Colóquese un poco de la mezcla en una muesca practicada sobre un carbón, y caliéntese fuertemente con un soplete de boca. Al cabo de un instante se podrá ver que en la muesca queda un residuo metálico esponjoso, de color rojizo, que no es otra cosa que cobre metálico. Al igual que se hiciera en el experimento anterior, repítaselo empleando cualquier otra sal de cobre. Los resultados serán análogos.
Reacciones por vía húmeda
El cobre origina dos series de compuestos: los cuprosos y los cúpricos. En los primeros actúa como monovalente, mientras que en los segundos se comporta como bivalente.
COMPUESTOS CUPROSOS
Reacción con los hidróxidos alcalinos (Los hidróxidos alcalinos, de sodio y potasio, reaccionan en frío con las soluciones de sales cuprosas, para producir un precipitado amarillo de hidróxido cuproso. Este precipitado, por ebullición pierde agua y se con vierte en óxido cuproso, de color rojo.
En un tubo de ensayo colóquese un poco de solución de cloruro cuproso. Añádasele poco a poco solución de hidróxido de potasio. Se advertirá que se forma al instante un precipitado amarillo, de hidróxido cuproso. Suspéndase entonces el agregado de hidróxido de potasio, y caliéntese en la llama de un mechero de Bunsen el tubo que contiene el precipitado. El color de éste irá haciéndose cada vez más oscuro, hasta convertirse en un rojo negruzco. Ello indica que el hidróxido ha dejado de ser tal, para transformarse en óxido.
Reacción con el hidrógeno sulfurado
Cuando una solución de sal cuprosa se trata con hidrógeno sulfurado, origina un precipitado negro de sulfuro cuproso. Este precipitado se disuelve en el ácido nítrico diluido caliente, en cuyo caso produce nitrato cúprico, de color azul. Al mismo tiempo se forma un precipitado de azufre.
Colóquese en un tubo de ensayo un poco de solución de cloruro cuproso, y hágase pasar a través de ella una corriente de hidrógeno sulfurado, producido por la acción del ácido clorhídrico diluido sobre el sulfuro de hierro. En seguida se verá la formación del precipitado negro de sulfuro cuproso Al cabo de uno o dos minutos de pasaje de la corriente de hidrógeno sulfurado suspéndasela, agréguese al tubo un poco de ácido nítrico diluido con dos volúmenes de agua, y llévese todo a ebullición. El precipitado negro se disuelve poco a poco, formando por último una solución transparente de hermoso color azul. Por último se deja todo en reposo. En el fondo del tubo de precipitados se verá que se ha formado un depósito blanquecino, que no es otra cosa que azufre.
COMPUESTOS CUPRICOS
Reacción con los hidróxidos alcalinos
La reacción de las sales cúpricas con los hidróxidos alcalinos es muy semejante a la de las sales cuprosas, con la única diferencia de que como resultado de ella se obtienen compuestos cúpricos, y no cuprosos.
Al tratar una sal cúprica con un hidróxido alcalino, de sodio o potasio, se forma un precipitado azul de hidróxido cúprico, que por ebullición pierde su agua y se convierte en óxido cúprico, de color negro pardusco.
En un tubo de ensayo se .coloca un poco de solución acuosa de sulfato de cobre (vitriolo azul). Se le añade lentamente solución de hidróxido de sodio. Se forma así un precipitado azul de hidróxido cúprico.
El tubo donde se haga esta reacción se lleva inmediatamente a la llama de un mechero de Bunsen y se calienta. Al instante se verá que el precipitado cambia su color por otro pardo, casi negro (fig. 2). Ello se debe a la transformación del hidróxido cúprico en óxido cúprico.
Reacción con el amoníaco
La reacción de las sales cúpricas con el amoníaco es muy interesante.
Cuando una solución de algún compuesto cúprico se trata con amoníaco, se forma un precipitado verde claro, pulverulento, de sal básica de cobre. Este precipitado se disuelve con suma facilidad en un exceso de amoníaco, formando entonces un líquido de color azul intenso. Si luego se trata con alcohol absoluto esta solución amoniacal concentrada, precipita un polvo cristalino, de color azul-violeta, que contiene un ion complejo de cobre.
En un tubo de ensayo colóquese un poco de solución acuosa de sulfato de cobre. Agréguesele amoníaco en solución acuosa (hidróxido de amonio), gota a gota y en forma muy lenta. Se formará así un precipitado de color verde claro. Sígase agregando amoníaco, agitando de tanto en tanto el tubo donde se realice la reacción. Llegará un momento en que el precipitado se redisuelva, y el líquido resultante adquiera un color azul muy intenso. Se añade un exceso de amoníaco. Se agita bien el tubo y se le agrega alcohol absoluto. Se advertirá que se forma un precipitado azul-violeta, que va a depositarse en el fondo del tubo.
Reacción con el sulfocianuro de potasio
Cuando un compuesto cúprico se trata con sulfocianuro de potasio, se produce una precipitación de sulfocianuro de cobre (cúprico), de color negro. Dicho precipitado presenta una peculiaridad, y es la de convertirse lentamente en sulfocianuro cuproso, blanco. Para acelerar esta conversión puede añadírsele ácido sulfuroso.
En un tubo de ensayo colóquese un poco de solución acuosa de sulfato de cobre, y añádasele con cuidado otro tanto de solución, también acuosa, de sulfocianuro de potasio. Se observará que al instante se forma un precipitado negro. Se deja de lado, en la gradilla, el tubo donde se hiciera esta operación, y se toma otro limpio, en el cual se vuelve a hacer la precipitación del sulfocianuro cúprico que, como se ha dicho, tiene color negro. A este mismo tubo se agrega un poco de ácido sulfuroso. Al instante el color del precipitado se volverá blanco, por haberse operado en él el cambio de la sal, de cúprica a cuprosa.
Luego de cierto lapso, se observa el tubo que se abandonara en la gradilla. Se apreciará que también en el precipitado que contiene se ha operado el cambio de color.
 Como Hacer
Como Hacer