Como hacer EXPERIMENTOS DE QUIMICA – AZUFRE
Por FRANCISCO JOSE VALLEJO
El AZUFRE ANHIDRIDO SULFUROSO
El azufre, al combinarse con el oxígeno, da lugar a la formación de un gas que es el anhídrido sulfuroso. A esta combinación ya nos hemos referido al hablar de mezcla y combinación, y vimos cómo se obtenía, quemando azufre dentro de una probeta, la que servía para recoger dicho gas, producto de esta combustión.
Cualquier persona, aunque nunca haya leído un libro de química, habrá visto alguna vez escrita la fórmula de este gas, que es S02. S, es el símbolo del azufre y O el del oxígeno; ahora bien; el 2 colocado como subíndice del 0, significa que dos átomos de oxígeno se combinan con uno de azufre para formar una molécula de anhídrido sulfuroso.
Además, el método de preparación a que ya nos hemos referido, veremos algunos otros que también dan lugar a interesantes experiencias.
Fig. 1.- Como hacer EXPERIMENTOS DE QUIMICA – AZUFRE
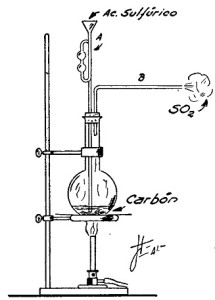
EXPERIMENTO 1.- Preparación del anhídrido sulfuroso partiendo del carbón
En un baloncito de 100 cm3 se colocan unos pedacitos de carbón del tamaño de una arveja más o menos.
En seguida se arma el dispositivo que se ve en la figura 92 y que consiste en tapar el balón con un tapón de corcho o goma atravesado por dos tubos, uno A de seguridad, en la forma que se indica en la figura, y otro B de desprendimiento.
Por el tubo de seguridad se agrega ácido sulfúrico concentrado y se calienta el balón interponiendo entre él y la llama una tela metálica con amianto.
Por este procedimiento económico se obtiene una producción bastante regular de anhídrido sulfuroso, pero presenta el inconveniente que, además del gas deseado, se desprende anhídrido carbónico y óxido de carbono, que lo impurifican.
Deben tomarse precauciones al hacer esta reacción, para evitar explosiones.
Además, no conviene hacerla en un balón muy grande, por la misma causa, y en ningún caso se deberá omitir el tubo de seguridad.
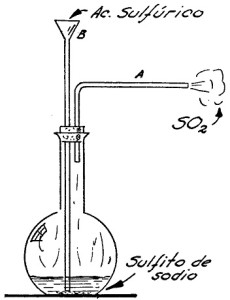
EXPERIMENTO 2.- Otro método de preparación de anhídrido sulfuroso
Por este método se puede trabajar en frio, es decir, que no es necesario calentar. Se arma el aparato que se ve en la figura 93. El tubo A, sirve como tubo de desprendimiento, y el B, que es de seguridad, lleva una especie de embudito en su extremidad exterior al matraz.
Se coloca en el matraz un poco de sulfito o bien bisulfito de sodio, y por el tubo B se vierte poco a poco ácido sulfúrico concentrado, agitando cada vez que se haga esta operación. En seguida se notará el desprendimiento de anhídrido sulfuroso por el tubo A, que se hará presente por su olor tan característico y conocido.
Fig. 2.- Como hacer EXPERIMENTOS DE QUIMICA – AZUFRE
Propiedades físicas del SO2
Como ya se ha dicho, es éste un gas de olor penetrante y asfixiante.
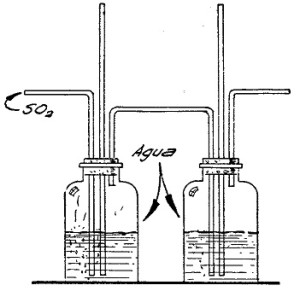
EXPERIMENTO 3.- Solubilidad en agua
El anhídrido sulfuroso es soluble en agua. Esto se puede comprobar realizando el siguiente experimento:
Se enlazan en serie dos frascos de boca ancha tapados con sendos corchos atravesados por tres tubos de vidrio, del modo que se ve en la figura 94.
Se parafinan bien los corchos para evitar pérdidas de gas, y se conecta el sistema a un aparato productor de anhídrido sulfuroso de los anteriormente citados.
Como es natural, el gas desprendido burbujeará en estos frascos que contendrán agua, y si se cuentan las burbujas que se desprenden del primero, veremos que son muchas más que que las que se desprenden del segundo, lo que prueba que parte del gas se ha disuelto en el agua contenida en el primer frasco.
Fig. 2.- Como hacer EXPERIMENTOS DE QUIMICA – AZUFRE
A la temperatura de 209 C., se pueden disolver 40 litros de gas en un litro de agua. Además de ser soluble en agua, también lo es en alcohol y en alcanfor.
Al disolverse en agua, el S02 da lugar a la formación de ácido sulfuroso, cuyo carácter ácido se prueba con un papel azul de tornasol en la forma que ya hemos indicado otras veces.
 Como Hacer
Como Hacer