Experimentos de quimica – HALOGENOS
Experimentos de quimica – HALOGENOS
Experimentos de quimica – halogenos, CURIOSAS EXPERIENCIAS REALIZADAS CON LOS HALOGENOS:
Los halógenos, cloro, bromo, iodo y flúor, constituyen una familia de elementos que dan lugar a interesantes experimentos, muchos de los cuales se pueden realizar con suma facilidad en el laboratorio del aficionado. De entre estos experimentos hemos escogido algunos de los más interesantes, para ofrecerlos hoy a nuestros lectores
Experimentos de quimica – halogenos, REACCIÓN ESPECTACULAR ENTRE EL IODO Y EL ALUMINIO:
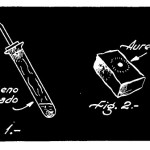
Comenzaremos con la descripción de estos experimentos con halógenos escogiendo al iodo para el primero, el cual es el único miembro de la familia que se presenta en estado sólido. En un mortero pequeño de porcelana colóquese 1 gramo, aproximadamente, de cristales de iodo, los cuales se muelen para convertirlos en un polvo muy fino. En seguida se añaden a esto 2 gramos de polvo de aluminio, y se revuelven bien ambas sustancias, para formar con ellas un polvo de composición uniforme. Hasta este momento no se habrá producido reacción alguna entre el iodo y el aluminio; no obstante, si se coloca la mezcla en un crisol de porcelana y se le agrega una gota de agua (con cuidado), con la ayuda de un cuentagotas de los que se usan para medicamentos, a los pocos segundos la temperatura de la mezcla aumentará notablemente, desprendiéndose al cabo de un instante gran cantidad de vapores de color púrpura, y ardiendo con resplandores rojizos del más bello efecto, (figura 1).
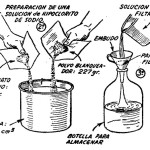
Fig. 1.- Experimentos de quimica – halogenos:
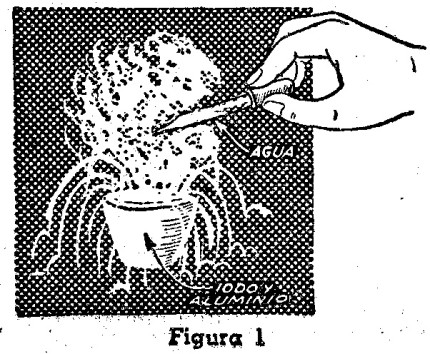
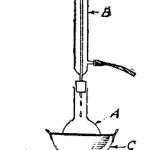
Fig. 2.- Experimentos de quimica – halogenos:
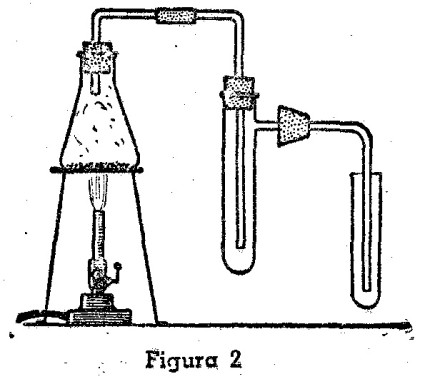 Para evitar la aspiración de los vapores desprendidos durante el experimento, se aconseja realizarlo bajo una campana, frente a una ventana abierta, o también al aire libre. En realidad, el agua no toma parte en la reacción entre el iodo y el aluminio, pues simplemente actúa como catalizador; esto es, como un compuesto que, sin intervenir en la reacción, ayuda a apresurarla.
Para evitar la aspiración de los vapores desprendidos durante el experimento, se aconseja realizarlo bajo una campana, frente a una ventana abierta, o también al aire libre. En realidad, el agua no toma parte en la reacción entre el iodo y el aluminio, pues simplemente actúa como catalizador; esto es, como un compuesto que, sin intervenir en la reacción, ayuda a apresurarla.
Experimentos de quimica – halogenos, PREPARACIÓN DEL ACIDO BROMHÍDRICO
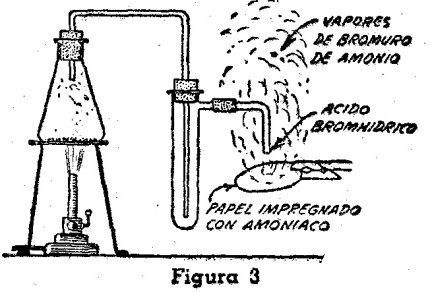
Fig. 3.- Experimentos de quimica – halogenos:
El ácido bromhídrico es una combinación entre el bromo y el hidrógeno. Veremos a continuación cómo se lo prepara. En un matraz Erlenmeyer de 200 c.c. de capacidad se colocan 15 gr. aproximadamente de bromuro de sodio. Se agrega en seguida ácido fosfórico siruposo (al 85 por ciento) hasta una altura de 3 mm., y se dispone el aparato como en la figura 2. El tubo de ensayo con tubuladura lateral sirve para condensar el vapor de agua que se desprenda del Erlenmeyer durante la reacción; mientras que el tubo final, que va abierto, permite recoger el gas ácido bromhídrico, el cual no escapa a la atmósfera por ser más pesado que el aire. Estando todo en orden, y las uniones perfectamente cerradas, se calienta moderadamente el matraz Erlenmeyer con la llama de un mechero de Bunsen.
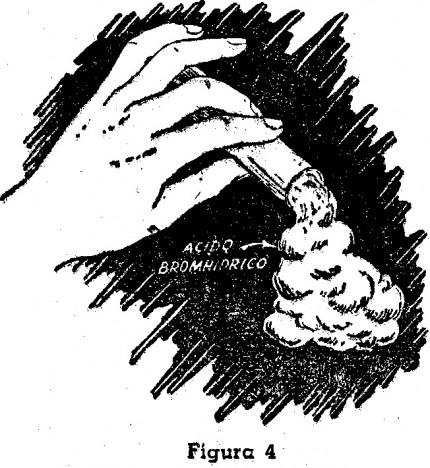
Fig. 4.- Experimentos de quimica – halogenos:
Al cabo de algunos minutos, en el tubo final del dispositivo se habrá recogido el ácido bromhídrico.
Si durante la producción del ácido bromhídrico, se separa del dispositivo el tubo colector, y se arrima al tubo de salida del gas un papel de filtro impregnado con amoníaco, se observará la producción de vapores densos y blanquecinos de bromuro de amonio, que recuerdan los que se forman cuando se juntan las bocas de dos frascos, de los cuales uno contenga ácido clorhídrico concentrado, y el otro amoníaco. La figura 3 ilustra cómo se realiza este experimento.
Una vez que se haya recogido el gas en el tubo de ensayo, se toma éste y se lo invierte, operando del mismo modo quo si contuviera agua, y se quisiera vaciar ésta en el aire (fig. 4). No bien el gas entre en contacto con el aire, produce una nube blanquecina, debido a que se combina con la humedad del aire. Si este experimento se realiza en una atmósfera cargada de humedad, su vistosidad será mucho mayor.
Fig. 5.- Experimentos de quimica – halogenos:
Es muy fácil demostrar que el ácido bromhídrico se descompone cuando se lo calienta. Se sumerge un trozo de algodón absorbente en una solución de fluoresceína, y luego se lo deja al aire, sobre un vidrio de reloj, hasta que se seque. El algodón presentará entonces una coloración amarillenta. Mientras tanto se llena un tubo de ensayo con ácido bromhídrico gaseoso, operando como ya se explicara en párrafos anteriores. Se tapa dicho tubo con el algodón preparado, el cual se humedece algo, y se calienta con la llama de un mechero de Bunsen. Por efectos del calor el ácido bromhídrico se descompone y deja bromo en libertad, el cual reacciona con la fluoresceína, que impregna al algodón, y la convierte en eosina, que es una materia colorante de color rojo. Por consiguiente, el viraje de amarillo a rojo del algodón durante el calentamiento, indica la descomposición del ácido bromhídrico. Obsérvese en la figura 5 la manera de llevar a cabo el experimento.
Experimentos de quimica – halogenos, ACCIÓN DE ALGUNAS SUSTANCIAS SOBRE LOS HIPOCLORITOS:
Fig. 6.- Experimentos de quimica – halogenos:
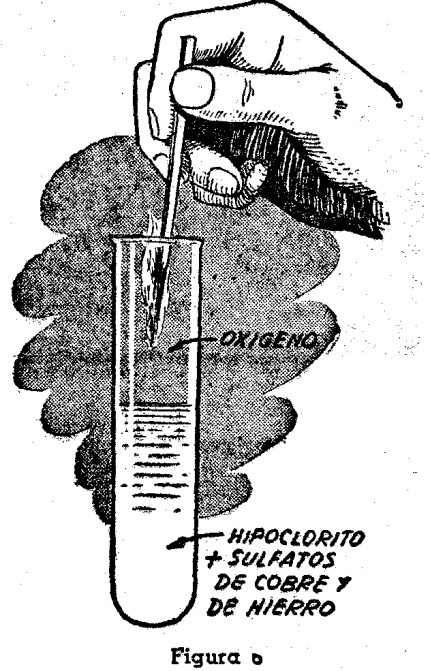
Los hipocloritos son derivados del cloro, que a su vez es Integrante de la familia de los halógenos. Dichos compuestos, al ser sometidos a la acción de ciertas sustancias, se descomponen, para poner oxígeno en libertad.
Fig. 7.- Experimentos de quimica – halogenos:
En un tubo de ensayo viértase una solución concentrada de hipoclorito de sodio hasta la tercera parte de su capacidad, y luego agréguense 4 c.c. de solución saturada de sulfato de cobre y otro tanto de solución saturada de sulfato ferroso. Agítese el contenido del tubo y déjese luego en reposo. Al cabo de un instante se apreciará que del líquido se desprenden burbujas de gas oxígeno, lo cual se demuestra introduciendo en el tubo una astillita de madera con su extremidad en ignición. Al entrar en contacto con el gas, la combustión de la madera se aviva, al punto que llega a encenderse en muchos casos (ver la figura 6).
Deja tus comentarios sobre:: Experimentos de quimica – halogenos
Experimentos de quimica – halogenos
Descarga aqui: experimentos de quimica – halogenos
 Como Hacer
Como Hacer



Pingback: Bitacoras.com