Como hacer – QUIMICA ANALITICA – EL COBRE (2 de 2)
Ensáyese la solubilidad en agua, y ácidos minerales diluidos y concentrados del precipitado blanco de sulfocianuro cuproso. Este sólo se disuelve en los ácidos concentrados.
Reacción con el hidrógeno sulfurado
El hidrógeno sulfurado, al atravesar una solución de un compuesto cúprico, origina un precipitado negro de sulfuro cúprico. Para evitar que el precipitado formado sea coloidal, conviene trabajar en un medio francamente ácido. El sulfuro cúprico se disuelve en ácido nítrico diluido, caliente y en el cianuro de potasio; es insoluble en el ácido sulfúrico diluido e hirviente. Esta última solubilidad se emplea en los laboratorios de química analítica para establecer la diferencia entre el cobre y el cadmio.
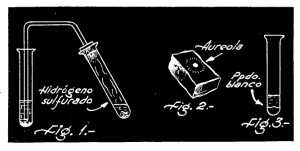
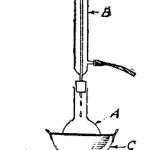
En un tubo de ensayo se vierten algunos centímetros cúbicos de solución de sulfato de cobre, y luego se hace pasar a través de ella una corriente de hidrógeno sulfurado, producido en un tubo de ensayo adyacente, haciendo reaccionar la pirita de hierro (sulfuro de hierro artificial), con ácido clorhídrico diluido (ver la figura 1 del grabado en azul). Antes de comenzar con el pasaje de hidrógeno sulfurado, conviene acidular la solución de sulfato de cobre con una buena cantidad de ácido clorhídrico.
El precipitado negro que se produce se trata con ácidos minerales, concentrados y diluidos, para comprobar su solubilidad.
CADMIO
El cadmio es un metal blanco, muy parecido al zinc, al cual acompaña en algunos de sus minerales. No se encuentra al estado libre en la naturaleza, pero sí bajo la forma de compuestos, entre ellos la greenockita, que es sulfuro de cadmio.
Este metal es dúctil; al ser Calentado en el aire se quema, produciendo humos pardos constituidos por óxido de cadmio. Se disuelve fácilmente en ácido nítrico. En ácidos clorhídrico y sulfúrico diluidos sólo se disuelve lentamente, con desprendimiento de hidrógeno.
Reacciones por vía seca
En un trocito de carbón practíquese una ligera concavidad, y en ella colóquese un poco de cloruro de cadmio Caliéntese fuertemente con la llama dirigida por un soplete de boca. Se observará que no se produce cambio aparente.
Repítase el ensayo, pero esta vez colocando en la concavidad del carbón una mezcla de cloruro de cadmio y carbonato de sodio anhidro, que previamente se habrá hecho en un mortero. El compuesto se funde y volatiliza, produciendo una áureo1 a marrón de óxido de cadmio a todo el rededor de la concavidad (fig 2, en azul).
Reacciones por vía húmeda
Sólo se verán las principales reacciones del cadmio por vía húmeda. En su realización deberá usarse una solución de alguna sal de cadmio, que muy bien puede ser de nitrato o de cloruro de cadmio. Muchas veces también se utiliza el sulfato de cadmio.
Fig.- Como hacer – QUIMICA ANALITICA – EL COBRE (2 de 2)
Reacción con los hidróxidos alcalinos
Cuando una sal de cadmio se trata con hidróxidos alcalinos (de sodio o potasio), se produce un precipitado blanco, amorfo, de hidróxido de cadmio, que no se re-disuelve en exceso de reactivo. Este precipitado, al ser calentado al rojo, se convierte en un polvo amarillo, que no es otra cosa que óxido de cadmio.
En un tubo de ensayo se coloca un poco de solución acuosa de cloruro de cadmio, y se le agrega en seguida lentamente solución de hidróxido de sodio. Se verá que inmediatamente se forma un precipitado blanco de hidróxido de cadmio (fig. 3, en azul).
Se recoge este precipitado sobre un filtro, se lava con agua y luego se lleva a un crisol de porcelana, donde se calienta fuertemente en la llama de un mechero de Bunsen. Por efectos del calentamiento, el hidróxido pierde agua y pasa al estado de óxido, que presenta una coloración marrón característica.
En un próximo articulo continuaremos con las reacciones por vía húmeda del cadmio.
 Como Hacer
Como Hacer