Como hacer EXPERIMENTOS DE QUIMICA
Como hacer EXPERIMENTOS DE QUIMICA
EL cromo es un metal muy conocido; por eso le dedicaremos un lugar en la serie de experimentos que desde hace ya algún tiempo se vienen publicando en esta revista. Comenzaremos, siguiendo la norma ya trazada, haciendo un poco de historia y "presentando" al elemento a través de sus propiedades.
El cromo se encuentra en la naturaleza, especialmente al estado de cromato férrico o cromita y en menor cantidad como crocoita o cromato de plomo.
A pesar de haber sido descubierto tal elemento en 1797 por Vauquelín, Moissan fué el primero que lo aisló en 1894, reduciendo el sesquióxido de cromo con carbón en el horno eléctrico. En nuestros días se obtiene cromo puro siguiendo el proceso de Goldschmidfc que consiste en reducir el sesquióxido de cromo mezclado con aluminio en polvo.
El cromo es un metal blanco brillante con reflejos grisáceos, muy duro, hasta el punto de rayar el vidrio. A 3000? C. se logra fundirlo. Su símbolo químico es Cr, y da lugar a la formación de dos series de sales: las crómicas y las cromosas.
Las sales de cromo han tomado gran popularidad debido a los conocidos procesos de galvanoplastegia y galvanoplastia , que permiten recubrimientos metálicos de cromo sobre distintas superficies.
EXPERIMENTO No. 69
Pasaje del anhidrido crómico a sesquióxido crómico
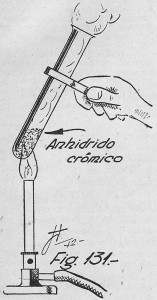
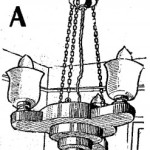
Se toma un tubo de ensayo y después de secarlo perfectamente, se le introduce un poco de anhidrido crómico seco. Se calienta moderadamente (fig. 131), tratando que el calor se reparta en forma uniforme por toda la masa del cuerpo, y tras un desprendimiento de oxígeno fácil de advertir, se verá que cambia de color. En efecto: el anhidrido crómico forma agujas rojas, y al desprender oxígeno por calentamiento, se transforma en sesquióxido de cromo de color verde intenso.
EXPERIMENTO No. 70
Obtención del anhidrido crómico
El anhidrido crómico o más comúnmente llamado ácido crómico, se puede preparar fácilmente en el laboratorio siguiendo el método que a continuación se indica.
Es éste uno de los compuestos de cromo más usado por los croma-dores, razón por la cual es muy solicitado, especialmente en las droguerías industriales. Para prepararlo, nos va a servir la sal de cromo más popular. Al decir esto, nos referimos, como ya algunos lectores habrán adivinado, al bicromato de potasio, substancia que se vende en en masas cristalinas de color anaranjado . Si no se consiguiera el bicromato de potasio o bien se deseare hacer alguna economía, se puede adquirir bicromato de sodio, que hará un papel análogo al de potasio .
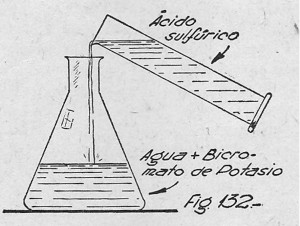
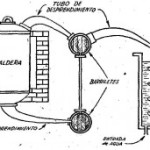
Se disuelven en un vaso eslenme-yer 300 gramos de esta sal en medio litro de agua (preferible si es destilada y se añaden 400 mililitros de ácido sulfúrico concentrado (figura 132) . La mezcla se deja en reposo de 10 a 12 horas; se decanta el líquido, con lo cual se separa el sulfato de potasio formado y se ca-calienta a 80 – 90°C.
Enseguida se añaden 150 mi. de ácido sulfúrico, formándose instantáneamente algunos cristales de anhídrido crómico, los cuales se redisuelven agregando la cantidad de agua necesaria para que tal cosa suceda. Se concentra algo la solución por medio de una evaporación de pocos minutos y por último se deja en reposo otras doce horas. Al cabo de este tiempo se verán en el fondo del vaso hermosos cristales aciculares de color rojo. Tales cristales son de anhídrido crómico.
Para obtener un mayor rendimiento, se separa el líquido que sobrenada sobre los cristales, que es una solución de anhídrido crómico, y por evaporación hasta síntomas de cristalización (proceso ya des-cripto en esta misma sección de HOBB'Y), se obtendrán nuevas cantidades del compuesto en cuestión. Esto último se puede repetir dos y ha&¿a tres veces. Los cristales obtenidos se pueden desecar sobre un
ladrillo o bien sobre una porcelana despulida.
EXPERIMENTO N0. 71
Cómo reconocer eí cromo en pequeñas cantidades
Ya saben los lectores, que siempre damos alguna reacción analítica cualitativa para los elementos que nos ocupan. Hoy daremos ia reacción de Lehner para el cromo, que permite identificarlo aún en pequeñísimas cantidades.
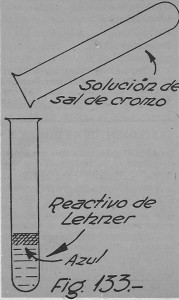
El reactivo de Lehner se preparará mezclando en un tubo de ensayo perfectamente limpio, éter, agua oxigenada y ácido sulfúrico.
Obtenido el reactivo identificador, se toma otro tubo de ensayo también muy limpio y se le pone agua destilada hasta una cuarta parte.
Enseguida se le agrega una o dos gotas de algún compuesto de cromo en solución y luego de agitado, se añade una pequeña porción de esta solución sobre el reactivo de Lehner (fig. 133).
La presencia de cromo la indicará la coloración azulada que toma la capa sobrenadante de éter.
Descarga para guardar o imprimir - GRATIS
 Como Hacer
Como Hacer


Gracias. Espero poder realizarlo. Hay riesgo de explosión al realizarlo?
TA CHIDO HAGAN MAS
Pingback: Como hacer experimentos de quimica - USOS DEL CALCIO | Como hacer con Manuales, Planos y Formulas gratis